Recommandation
Comment certains gènes peuvent à la fois provoquer l’autisme et ouvrir la voie à de nouveaux traitements
Trois enfants ont grandi dans le même foyer, élevés par les mêmes parents et exposés au même environnement. Pourtant, leurs vies ont pris des chemins radicalement différents – tout cela à cause d’un seul gène. Trois enfants, un seul gène différent, trois destins bouleversés.

Photo: Illustration de Lumi Liu
Le frère aîné a franchi toutes ses étapes de développement dans les temps et savait lire à l’âge de 5 ans. Il avait une excellente mémoire pour les plaques d’immatriculation et faisait rapidement des calculs mentaux. Ses difficultés sociales, en revanche, sont apparues dès son entrée à l’école. Mal à l’aise en société, il avait peu d’amis, ne comprenait pas les codes sociaux et connaissait des sautes d’humeur. Il a été diagnostiqué avec le syndrome d’Asperger, aujourd’hui inclus dans le spectre de l’autisme.
Son frère cadet s’est développé normalement, sans aucun signe d’autisme ni autre trouble du développement.
La petite sœur, en revanche, a développé une forme d’autisme associée à une déficience intellectuelle. Bébé, elle avait atteint ses premières étapes motrices, mais son langage était très retardé. Elle a dû quitter l’école à l’âge de 7 ans pour suivre un programme hospitalier en journée. À 12 ans, ses capacités intellectuelles étaient comparables à celles d’un enfant de moins de 6 ans, et bien qu’elle puisse parler un peu, elle faisait souvent des erreurs de prononciation. Elle présentait également des comportements auto-agressifs, comme se frapper la tête, et souffrait d’énurésie nocturne.
La différence clé entre les comportements de ces enfants résidait dans le nombre de copies d’un gène héréditaire appelé SHANK3 qu’ils possédaient chacun.
Ce cas unique a été découvert par des chercheurs français. Le schéma d’héritage particulier de cette famille offre un aperçu de la complexité génétique de l’autisme.
Joseph Buxbaum, directeur du Seaver Autism Center for Research and Treatment à la Icahn School of Medicine du Mount Sinai (New York, États-Unis), a expliqué à Epoch Times que l’autisme possède une forte composante génétique. Cependant, à première vue, le lien entre l’autisme et la génétique d’une personne n’est pas toujours évident.
Deux principaux moteurs génétiques
Deux grands types de gènes sont à l’origine de l’autisme : les mutations dites de novo et les variations polygéniques.
Les mutations de novo sont de nouveaux changements génétiques qui apparaissent spontanément dans l’ovule ou le spermatozoïde et ne sont pas hérités d’un parent. La majorité des recherches génétiques se concentrent sur la recherche de ces mutations. Elles sont rares et ne concernent qu’une petite proportion des cas d’autisme, mais elles exercent un effet fort sur ceux qui les portent. Une seule variation de novo peut suffire à provoquer l’autisme, et l’enfant aura plus de risques de présenter des caractéristiques sévères, comme un quotient intellectuel plus faible et un besoin accru de prise en charge.
Les variations polygéniques sont des causes bien plus fréquentes, représentant jusqu’à 50 % des cas d’autisme. Elles sont toutefois plus difficiles à identifier, car elles impliquent souvent des centaines, voire des milliers de gènes, chacun ayant un effet minime. Joseph Buxbaum, cofondateur de l’Autism Sequencing Consortium, un groupe international de chercheurs partageant des échantillons et des données sur l’autisme, compare ces effets subtils à ceux des gènes influençant la taille : « J’ai quelques variantes communes associées à une petite taille, et pourtant je mesure 1,95 m, vous voyez ? »
Des recherches estiment que les gènes sont à l’origine d’environ 60 % des cas d’autisme. (Epoch Times)
Toutes les personnes porteuses de variants génétiques liés à l’autisme ne développeront pas forcément la maladie, car tout dépend de l’ensemble de leur patrimoine génétique. Cette interaction complexe entre gènes qui s’opposent ou se renforcent explique pourquoi l’hérédité de l’autisme est si difficile à déchiffrer.
Le schéma familial de l’autisme fournit souvent des indices sur la nature de la cause génétique. Lorsqu’un seul enfant est atteint, une mutation de novo est la cause la plus probable. Lorsque plusieurs enfants sont touchés, les variations héréditaires sont généralement en cause.
Des gènes spécifiques
Plus d’une centaine de gènes ont été fortement associés à un risque accru d’autisme. Ces gènes interviennent dans la formation, la maturation et la communication des cellules cérébrales. Le gène SHANK3 participe à la fabrication des protéines qui assurent la connexion entre les neurones. Si ces connexions se forment mal — qu’il y ait trop ou trop peu de copies du gène — la communication entre les cellules cérébrales peut être altérée.
Le gène SHANK3 se trouve sur le chromosome 22. Dans l’histoire des trois enfants, le frère au développement typique possédait les deux copies normales du gène. Le frère aîné, atteint d’un autisme léger, avait hérité d’un fragment supplémentaire du chromosome 22, en plus de ses deux copies normales. La sœur, atteinte d’un autisme sévère, n’avait qu’une seule copie normale à cause d’un fragment manquant du chromosome 22.

Trois frères et sœurs présentaient des quantités différentes de matériel génétique sur le chromosome 22. (Epoch Times)
Un autre exemple est celui du gène CHD8, qui régule la manière dont l’ADN est organisé dans les cellules et détermine l’activation de certains gènes. Une mutation de CHD8 peut empêcher l’activation des gènes nécessaires au développement. Les anomalies de ce gène ont été associées à des troubles de la croissance des cellules cérébrales.
Certains gènes agissent plus indirectement. Par exemple, la phénylcétonurie, une maladie génétique, empêche l’organisme de décomposer l’acide aminé phénylalanine. Les enfants atteints qui consomment des aliments contenant cette substance peuvent accumuler des niveaux toxiques qui nuisent au développement cérébral, provoquant des symptômes proches de l’autisme.
Les facteurs environnementaux influencent aussi le risque génétique. Tout le monde accumule des mutations de novo au cours de sa vie, mais les personnes âgées, les fumeurs ou celles exposées aux radiations et aux produits toxiques en développent davantage. Avec l’âge des parents, le risque d’avoir un enfant autiste augmente, car leurs ovules et spermatozoïdes accumulent plus de mutations.
L’autisme sévère pourrait être traitable
Connaître les anomalies génétiques d’une personne autiste permet d’envisager un traitement. Des chercheurs ont découvert que certains symptômes invalidants pouvaient être atténués, voire inversés.
« Lorsque nous examinons des individus autistes présentant un handicap intellectuel important, la probabilité d’identifier la cause sous-jacente grâce au séquençage complet du génome est d’environ 30 à 35 % », explique le Dr Christian Schaaf, directeur médical de l’Institut de génétique humaine de l’Université de Heidelberg et découvreur du syndrome de Schaaf-Yang.
« Chez les personnes présentant un autisme à haut fonctionnement sans déficience intellectuelle, cette probabilité est inférieure à 10 %. »
Les études génétiques sont donc plus utiles pour les enfants atteints d’autisme sévère accompagné d’un retard intellectuel que pour ceux nécessitant moins de soutien, précise le Dr Schaaf.
L’idée de traiter l’autisme peut être controversée, notamment au sein du mouvement pour la neurodiversité, dont certains membres considèrent ces traitements comme une tentative d’effacer des traits faisant partie intégrante de leur identité.
Cependant, les personnes autonomes et capables de s’exprimer ne sont pas les patientes concernées par ces interventions. Ces traitements n’ont pas pour objectif d’éliminer la neurodiversité, souligne Joseph Buxbaum.
« Il est important de rappeler que l’autisme est un spectre incroyablement large, dit-il. Lorsque nous parlons de traitement ou de thérapies géniques ciblées, il s’agit uniquement de l’autisme profond. »
« Si quelqu’un se situe sur le spectre mais a simplement un peu de mal lors des entretiens d’embauche parce qu’il ne saisit pas toujours les codes sociaux, on peut lui proposer un accompagnement adapté – il n’a pas besoin d’une thérapie génique. »
Les thérapies ciblées sur les gènes reposent sur plusieurs approches. La plus connue consiste à modifier le code génétique d’une personne. Ces traitements sont controversés et peuvent, dans de rares cas, entraîner de nouveaux problèmes génétiques.
D’autres traitements, plus conservateurs, existent.
Si un enfant possède un gène défectueux et un autre sain, les médecins peuvent recourir à un médicament destiné à stimuler le gène fonctionnel, afin de compenser l’effet du gène altéré. Cette stratégie n’est pas toujours possible, surtout lorsque le gène est difficile à cibler ou que plusieurs gènes sont impliqués.
Une autre approche consiste à corriger les effets indirects. Si une anomalie provoque, par exemple, une carence en nutriment essentiel que le gène normal ne peut corriger, on peut compenser en administrant ce nutriment.
L’équipe du Dr Schaaf a illustré ce principe chez un garçon de 4 ans qui régressait dans son développement : il perdait la parole et devenait agité et agressif. Les tests biochimiques et génétiques ont révélé une mutation du gène TMLHE, entraînant une grave carence en carnitine. En supplémentant l’enfant en carnitine, la régression a cessé, son langage s’est amélioré et il est devenu plus calme.
D’autres affections similaires
Les maladies génétiques héréditaires ont longtemps été considérées comme incurables, mais la recherche pourrait bien changer cette vision.
Un essai clinique en cours s’intéresse au syndrome d’Angelman, qui provoque un retard de développement et est souvent lié à l’autisme. Il résulte d’une anomalie ou d’une absence du gène UBE3A hérité de la mère.
Un enfant en bonne santé hérite de deux copies du gène UBE3A, une de chaque parent. Dans le syndrome d’Angelman, la copie paternelle s’éteint durant le développement cérébral. Si la copie maternelle est défectueuse ou absente, le développement cérébral est perturbé, provoquant la maladie.
L’essai en cours vise à réactiver la copie paternelle du gène UBE3A à l’aide de protéines spécifiques. Les premiers résultats montrent des améliorations significatives chez les enfants traités.
« Le plus frappant, c’est qu’on observe des progrès dans la cognition, le langage et les capacités de vie quotidienne », indique Joseph Buxbaum. Ces améliorations sont cruciales pour l’autonomie, souligne-t-il, car de nombreux enfants autistes présentant une déficience intellectuelle nécessitent une assistance à vie.
Un autre essai mené chez des hommes atteints du syndrome du X fragile a également montré des progrès cognitifs. Ce trouble provoque des retards de développement et des difficultés d’apprentissage en raison d’un déficit d’une molécule de signalisation cérébrale appelée AMPc. Les chercheurs ont découvert qu’en augmentant les niveaux d’AMPc, les participants adultes amélioraient leurs capacités cognitives et leur comportement.
« Si ces essais et d’autres encore montrent des résultats positifs, on commencera à envisager ces troubles comme potentiellement traitables », déclare Joseph Buxbaum.
Une vision partielle
Toutes les personnes autistes ne présentent pas une variation génétique facilement ciblable. La plupart possèdent des centaines, voire des milliers de variants.
Joseph Buxbaum pense qu’avec davantage de recherche, les scientifiques pourront identifier les grands circuits neurobiologiques impliqués dans l’autisme. Il ne serait alors plus nécessaire de trouver chaque variant génétique individuellement : cibler les voies clés pourrait suffire.
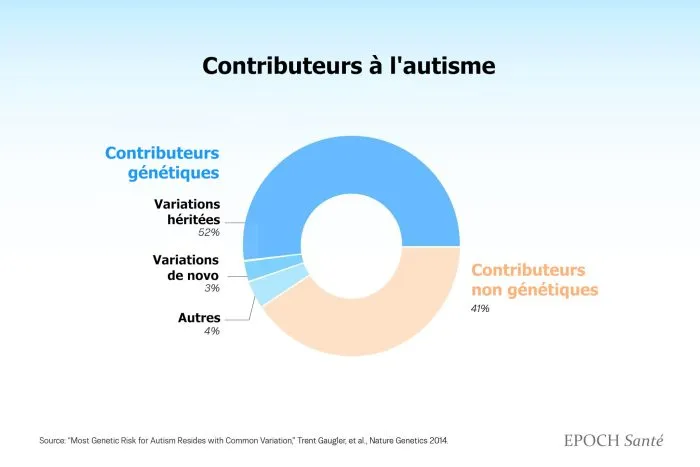
Mais la génétique ne raconte pas toute l’histoire. Les chercheurs estiment qu’environ 60 % des cas d’autisme ont une origine génétique.
Les 40 % restants s’expliqueraient en partie par des limites de calcul ou un manque d’échantillons, mais aussi par des facteurs environnementaux.
Depuis les années 1980, la prévalence de l’autisme est passée d’environ 0,06 % à 3,2 %.
Une partie de cette hausse s’explique par de meilleurs critères de diagnostic, voire par une surestimation des taux actuels, mais pas entièrement. Les formes les plus sévères – l’autisme profond – ont augmenté d’environ 70 % entre les années 2000 et 2016, selon les données des Centers for Disease Control and Prevention américains.
« Quand les taux montent autant, ce n’est pas parce que les gènes changent, il doit y avoir un facteur environnemental ou diagnostique qui intervient », explique Neil Risch, directeur de l’Institute for Human Genetics de l’Université de Californie à San Francisco.
Même chez les jumeaux identiques, partageant le même patrimoine génétique, il arrive que l’un soit autiste et l’autre non, ce qui montre le rôle de l’environnement, poursuit Neil Risch.
« Les études sur les jumeaux partent du principe que l’environnement est partagé de la même façon entre jumeaux identiques et fraternels, ce qui n’est pas forcément vrai », ajoute-t-il.
Dans l’utérus, chaque jumeau occupe une position différente, ce qui peut entraîner des expositions inégales — l’un recevant peut-être plus de nutriments que l’autre.
La science en est encore à ses débuts.
À l’image de la parabole des aveugles et de l’éléphant, se concentrer uniquement sur la génétique ne révèle qu’une partie de l’histoire de l’autisme. Au-delà du plan génétique, les facteurs environnementaux, le développement et la biologie propre à chaque individu jouent aussi un rôle.

Marina Zhang est rédactrice spécialisée dans la santé pour Epoch Times, basé à New York. Elle couvre principalement des articles sur le COVID-19 et le système de santé. Elle est titulaire d'une licence en biomédecine de l'université de Melbourne. Contactez-la à l'adresse marina.zhang@epochtimes.com.
Articles actuels de l’auteur









